Zestaw do izolacji całkowitego RNA roślin Zestaw do oczyszczania całkowitego RNA dla roślin o niskiej zawartości polisacharydów i polifenoli
Specyfikacje
50 przygotowań, 200 przygotowań
Zestaw wykorzystuje kolumnę wirówkową i formułę opracowaną przez Foregene, która może skutecznie ekstrahować całkowity RNA o wysokiej czystości i wysokiej jakości z różnych tkanek roślinnych o niskiej zawartości polisacharydów i polifenoli.W przypadku próbek roślinnych o wysokiej zawartości polisacharydów lub polifenoli zaleca się użycie zestawu Plant Total RNA Isolation Plus Kit, aby uzyskać lepsze wyniki ekstrakcji RNA.Zestaw zawiera kolumnę DNA-Cleaning, która umożliwia łatwe usuwanie genomowego DNA z supernatantu i lizatu tkankowego.Kolumna zawierająca tylko RNA może skutecznie wiązać RNA.Zestaw może przetwarzać dużą liczbę próbek w tym samym czasie.
Cały system nie zawiera RNazy, dzięki czemu oczyszczony RNA nie ulegnie degradacji.Buffer PRW1 i Buffer PRW2 zapewniają, że otrzymane RNA nie jest zanieczyszczone białkiem, DNA, jonami i związkami organicznymi.
Elementy zestawu
| Bufor PSL1, Bufor PS, Bufor PSL2 |
| Bufor PRW1, Bufor PRW2 |
| ddH wolne od RNaz2O, Kolumna Czyszcząca DNA |
| Kolumna tylko z RNA |
| Instrukcje |
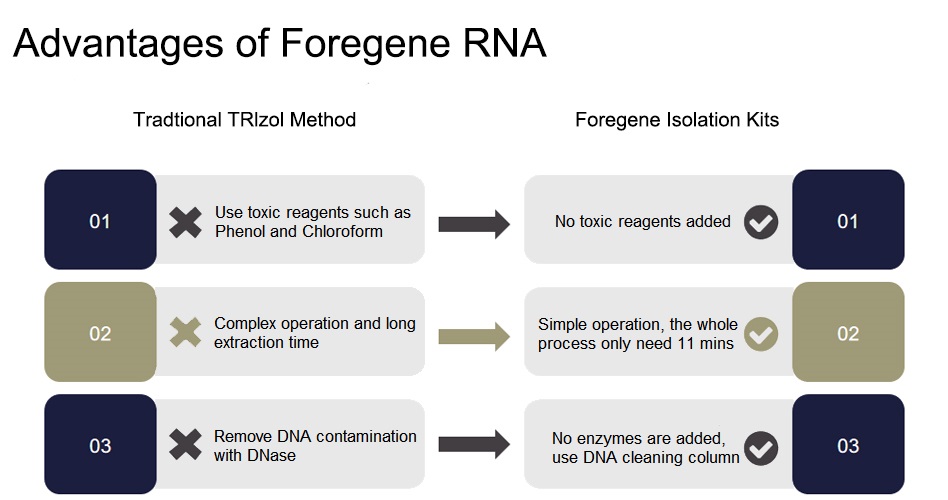
Funkcje i zalety
■ Praca w temperaturze pokojowej (15-25℃) przez cały proces, bez kąpieli lodowej i wirowania w niskiej temperaturze.
■ Kompletny zestaw nie zawiera RNaz, nie trzeba się martwić o degradację RNA.
■ Kolumna czyszcząca DNA specyficznie wiąże się z DNA, dzięki czemu zestaw może usuwać zanieczyszczenia genomowym DNA bez dodawania DNazy.
■ Wysoka wydajność RNA: Kolumna tylko z RNA i unikalna formuła mogą skutecznie oczyszczać RNA.
■ Duża prędkość: łatwy w obsłudze i można go ukończyć w ciągu 30 minut.
■ Bezpieczeństwo: nie jest wymagany żaden odczynnik organiczny.
■ Wysoka jakość: Oczyszczone fragmenty RNA charakteryzują się wysoką czystością, są wolne od białek i innych zanieczyszczeń i mogą znaleźć zastosowanie w różnych dalszych zastosowaniach eksperymentalnych.
Aplikacja zestawu
Nadaje się do ekstrakcji i oczyszczania całkowitego RNA ze świeżych lub mrożonych próbek tkanek roślinnych (zwłaszcza świeżej tkanki liści roślin) o niskiej zawartości polisacharydów i polifenoli.
Przepływ pracy
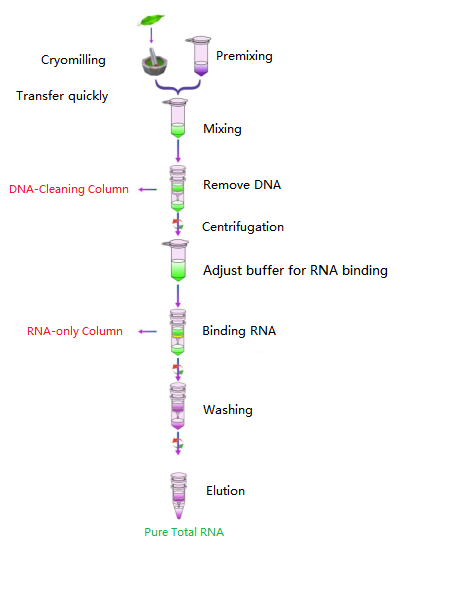
Diagram
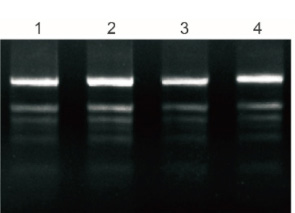
Plant Total RNA Isolation Kit Plus przetwarzał 50 mg świeżych liści polisacharydów i polifenoli, a 5% oczyszczonego RNA badano metodą elektroforezy.
1: Banan
2: Miłorząb
3: Bawełna
4: Granat
Przechowywanie i trwałość
Zestaw można przechowywać przez 12 miesięcy w temperaturze pokojowej (15–25 ℃) w suchym środowisku, a w temperaturze 2–8 ℃ dłużej (24 miesiące).
Bufor PSL1 można przechowywać w temperaturze 4 ℃ przez 1 miesiąc po dodaniu 2-hydroksy-1-etanotiolu (opcjonalnie).
Przewodnik po analizie problemu
Poniższa analiza problemów, które możesz napotkać wSuma roślinRNA extraction will help you with your experiments. In addition, for other experimental or technical problems in addition to operating instructions and problem analysis, we have dedicated technical support to help you. If you have any needs, please contact us at: 028-83360257 or E-mali : Tech@foregene.com.
Kolumna wirująca jest zatkana
Zablokowanie kolumny wirówkowej spowoduje zmniejszenie wydajności RNA lub wręcz uniemożliwienie jego oczyszczenia w celu uzyskania RNA, a jakość otrzymanego RNA będzie niska.
Analiza wspólnej przyczyny:
1. Próbka nie jest całkowicie rozbita.
Niepełna fragmentacja próbki może zablokować kolumnę czyszczącą DNA, co może również wpłynąć na wydajność i jakość RNA.Zalecamy, aby podczas rozdrabniania próbek szybko rozdrobnić wystarczającą ilość ciekłego azotu, aby w jak największym stopniu rozbić tkanki, takie jak ściany komórkowe i błony komórkowe próbek.W przypadku roślinnych próbek polisacharydów polifenolowych zalecamy użycie zestawu Plant Total RNA Isolation Kit Plus.
2. Zaaspirować supernatant wyizolowany z kolumny czyszczącej DNA, zaaspirować ewentualne osady komórkowe.
Odessany osad komórek może zatkać kolumnę zawierającą tylko RNA podczas procedur adsorpcji RNA (patrz krok 5 procedury, krok 6 procedury polisacharydów i polifenoli).Zalecamy zachowanie ostrożności podczas odsysania tego supernatantu, aby uniknąć zassania resztek komórek.
3. Początkowa ilość próbki jest zbyt duża.
Nadmierne użycie próbki spowoduje niepełną fragmentację próbki lub niepełną lizę komórek przez bufor PRL1 lub bufor PSL1, co spowoduje zatkanie kolumny oczyszczającej podczas operacji oczyszczania.Plant Total RNA Isolation Kit ma początkowe maksimum 50 mg na pojedyncze oczyszczanie operowanej próbki.W przypadku roślinnych próbek polisacharydów polifenolowych zalecamy wypróbowanie zestawu Plant Total RNA Isolation Kit Plus.
4. Temperatura wirówki jest zbyt niska.
Izolacja i oczyszczanie całego RNA, z wyjątkiem rozerwania próbki tkanki ciekłym azotem, wszystkie etapy przeprowadza się w temperaturze pokojowej (20-25°C).Niektóre wirówki niskotemperaturowe mają temperaturę poniżej 20°C, co może powodować zatykanie kolumny czyszczącej DNA i/lub kolumny zawierającej tylko RNA.W takim przypadku należy ustawić temperaturę wirówki na 20–25 °C i wstępnie ogrzać mieszaninę lizującą i/lub supernatant rozdzielający z dodatkiem etanolu do 37 °C.
Brak ekstrakcji RNA lub wydajność RNA jest niska
Zwykle na skuteczność odzysku wpływa wiele czynników, takich jak: zawartość RNA w próbce, sposób działania, objętość elucji itp.
Analiza typowych przyczyn, jak poniżej:
1. Podczas operacji wykonano łaźnię lodową lub wirowanie w niskiej temperaturze (4°C).
Sugestia: Pracować w temperaturze pokojowej (15-25°C) przez cały proces, nie wykonywać kąpieli lodowej i wirowania w niskiej temperaturze.
2.RNA uległ degradacji z powodu niewłaściwej konserwacji próbki lub długotrwałej konserwacji próbki.
Zalecenie: Świeżo pobrane próbki należy szybko zamrozić w ciekłym azocie, a następnie przechowywać przez długi czas w temperaturze -80°C, unikać wielokrotnego zamrażania i rozmrażania próbek;lub natychmiast zanurz próbki w roztworze stabilizatora RNA RNAlater (próbki zwierzęce).
3.Niewystarczająca fragmentacja próbki i liza prowadzą do zablokowania kolumny oczyszczającej.
Sugestia: Podczas rozdrabniania tkanki upewnij się, że jest ona wystarczająco zmielona i szybko przenieś ją do wcześniej przygotowanego buforu Buffer PSL1 (upewnij się, że została dodana prawidłowa proporcja β-ME, patrz krok 1 procedury).
4. Eluent został dodany nieprawidłowo.
Sugestia: Upewnij się, że ddH2O wkrapla się na środek membrany kolumny oczyszczającej.
5. Do buforu Buffer PSL2 lub Buffer PRW2 nie dodano właściwej objętości etanolu absolutnego.
Sugestia: Postępuj zgodnie z instrukcjami, dodaj odpowiednią objętość etanolu absolutnego do buforów Buffer PSL2 i Buffer PRW2 i dobrze wymieszaj przed użyciem zestawu.
6. Ilość próbki tkanki jest niewłaściwa.
Sugestia: Użyj 50 mg tkanki na 500 μl buforu Buffer PSL1.Użycie zbyt dużej ilości tkanki zmniejszy ilość ekstrahowanego RNA, a także zmniejszy się czystość otrzymanego RNA.Zdecydowanie zalecamy, aby początkowa dawka próbki nie przekraczała 50 mg na operację ekstrakcji RNA.
7. Niewłaściwa objętość elucji lub niepełna elucja.
Sugestia: Objętość eluentu kolumny oczyszczającej wynosi 50-200 μl;jeśli efekt elucji nie jest zadowalający, zaleca się wydłużenie czasu w temperaturze pokojowej po dodaniu podgrzanego ddH wolnego od RNaz2O, np. 5-10 min.
8. Kolumna oczyszczająca zawiera pozostałości etanolu po przemyciu buforem PRW2.
Sugestia: Jeśli pusta probówka jest wirowana przez 1 min, a po przepłukaniu buforem PRW2 nadal pozostaje etanol, można wydłużyć czas wirowania pustej probówki do 2 min lub umieścić kolumnę oczyszczającą w temperaturze pokojowej na 5 min, aby całkowicie usunąć pozostały etanol.
9.Zestaw został użyty nieprawidłowo.
Sugestia: W przypadku roślinnych próbek polisacharydów polifenolowych użycie typowych zestawów, takich jak Plant Total RNA Isolation Kit, może nie być w stanie uzyskać idealnych próbek RNA.Zalecamy użycie zestawu Plant Total RNA IsolationKit Plus, który jest specjalnie zaprojektowany do próbek roślinnych polisacharydów polifenolowych.Zestaw opracowany specjalnie do ekstrakcji RNA z polifenoli i polisacharydów z próbek roślinnych.
Wartość OD260/OD280 jest niska
Elucja RNA za pomocą ddH2O i używany do odczytów spektrofotometru daje niskie wartości OD260/OD280.Zalecamy stosowanie 10 mM Tris-HCl, pH 7,5 (zamiast ddH wolnego od RNaz2O w celu elucji RNA) w celu uzyskania względnie prawidłowych wartości OD260/OD280, patrz „Oznaczenia stężenia i oczyszczania RNA” na stronie 19.
Oczyszczony RNA ulega degradacji
Jakość oczyszczonego RNA jest związana z takimi czynnikami, jak konserwacja próbki, zanieczyszczenie RNazą i manipulacja.
Analiza najczęstszych przyczyn:
1. Próbki tkanek nie były przechowywane w odpowiednim czasie po pobraniu.
Zalecenie: Jeśli próbki tkanek nie zostaną wykorzystane w czasie po pobraniu, należy natychmiast przechowywać je w ciekłym azocie w niskiej temperaturze lub przenieść je do -80°C w celu długotrwałego przechowywania po szybkim zamrożeniu w ciekłym azocie lub natychmiast zanurzyć próbki w roztworze stabilizatora RNA RNAlater (próbki zwierzęce).Do ekstrakcji RNA spróbuj użyć świeżo pobranych próbek tkanek.
2. Wielokrotne zamrażanie i rozmrażanie próbek tkanek.
Sugestia: Podczas przechowywania próbek tkanek najlepiej jest pociąć je na małe kawałki w celu konserwacji i wyjąć część z nich podczas ich używania, aby uniknąć degradacji RNA spowodowanej wielokrotnym zamrażaniem i rozmrażaniem próbek.
3. RNaza jest wprowadzana na salę operacyjną lub nie noszone rękawiczki jednorazowe, maseczki itp.
Sugestia: Eksperymenty z ekstrakcją RNA najlepiej przeprowadzać w oddzielnych operacjach RNA, a stół laboratoryjny powinien być wyczyszczony przed eksperymentem, a podczas eksperymentu należy nosić jednorazowe rękawiczki i maski, aby w największym stopniu uniknąć degradacji RNA spowodowanej wprowadzeniem RNazy.
4. Odczynnik jest zanieczyszczony RNazą podczas użycia.
Sugestia: Zastąp nową serią zestawów do ekstrakcji całkowitego RNA roślinnego do powiązanych eksperymentów.
5. Probówki wirówkowe i końcówki pipet używane do manipulacji RNA są zanieczyszczone RNazą.
Sugestia: Upewnij się, że probówki wirówkowe, końcówki do pipet, pipety itp. używane do ekstrakcji RNA są wolne od RNaz.
Podręczniki:
Instrukcja obsługi zestawu do izolacji całkowitego RNA roślin