Plant Total RNA Isolation Kit Plus Total RNA Purificaiton Kit dla roślin bogatych w polisacharydy i polifenole
Specyfikacje
50 przygotowań, 200 przygotowań
Zestaw wykorzystuje kolumnę wirówkową i formułę opracowaną przez Foregene, która może skutecznie ekstrahować całkowity RNA o wysokiej czystości i wysokiej jakości z różnych tkanek roślinnych o wysokiej zawartości polisacharydów lub polifenoli.Zapewnia kolumnę DNA-Cleaning, która może łatwo usunąć genomowe DNA z supernatantu i lizatu tkankowego.Kolumna zawierająca tylko RNA może skutecznie wiązać RNA.Zestaw może przetwarzać dużą liczbę próbek w tym samym czasie.
Cały system nie zawiera RNazy, dzięki czemu oczyszczony RNA nie ulegnie degradacji.Buffer PRW1 i Buffer PRW2 zapewniają, że otrzymane RNA nie jest zanieczyszczone białkiem, DNA, jonami i związkami organicznymi.
Elementy zestawu
| Bufor PSL1, Bufor PS, Bufor PSL2 |
| Bufor PRW1, Bufor PRW2 |
| ddH wolne od RNaz2O, Kolumna Czyszcząca DNA |
| Kolumna tylko z RNA |
Funkcje i zalety
■ Praca w temperaturze pokojowej (15-25℃) przez cały proces, bez kąpieli lodowej i wirowania w niskiej temperaturze.
■ Kompletny zestaw nie zawiera RNaz, nie trzeba się martwić o degradację RNA.
■ Szczególnie nadaje się do oczyszczania RNA z próbek roślinnych z polisacharydów i polifenoli.
■ Kolumna czyszcząca DNA specyficznie wiąże się z DNA, dzięki czemu zestaw może usuwać zanieczyszczenia genomowym DNA bez dodawania DNazy.
■ Wysoka wydajność RNA: Kolumna tylko z RNA i unikalna formuła mogą skutecznie oczyszczać RNA.
■ Duża prędkość: łatwy w obsłudze i można go ukończyć w ciągu 30 minut.
■ Bezpieczeństwo: nie jest wymagany żaden odczynnik organiczny.
■ Wysoka jakość: Oczyszczone fragmenty RNA charakteryzują się wysoką czystością, są wolne od białek i innych zanieczyszczeń i mogą znaleźć zastosowanie w różnych dalszych zastosowaniach eksperymentalnych.
Parametry produktu
■ Dalsze zastosowania: synteza pierwszej nici cDNA, RT-PCR, klonowanie molekularne, Northern Blot itp.
■ Próbka: Świeże lub mrożone tkanki roślinne zawierające polisacharydy i polifenole
■ Dawkowanie: 50mg tkanki roślinnej
■ Maksymalna zdolność wiązania RNA kolumny oczyszczającej: 80 μg
■ Objętość elucji: 50-200 μl
Aplikacja zestawu
Nadaje się do ekstrakcji i oczyszczania całkowitego RNA ze świeżych lub mrożonych próbek tkanek roślinnych (zwłaszcza świeżej tkanki liści roślin) o wysokiej zawartości polisacharydów i polifenoli.
Przepływ pracy
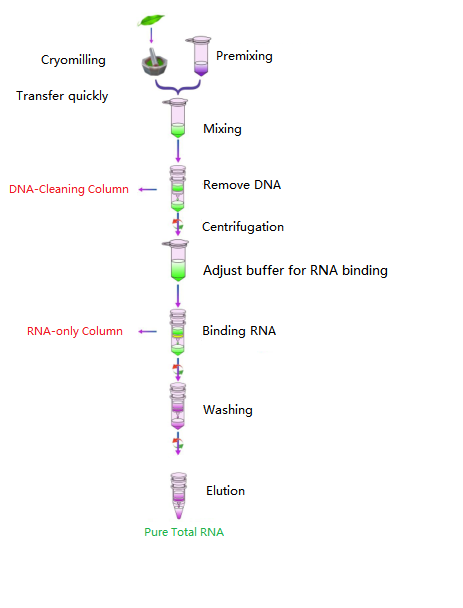
Diagram
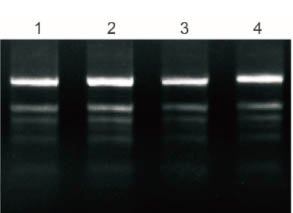
Plant Total RNA Isolation Kit Plus przetwarzał 50 mg świeżych liści polisacharydów i polifenoli, a 5% oczyszczonego RNA badano metodą elektroforezy.
1: Banan
2: Miłorząb
3: Bawełna
4: Granat
Przechowywanie i trwałość
Ten zestaw można przechowywać przez 24 miesiące w suchych warunkach w temperaturze pokojowej (15-25 ℃);jeśli musi być przechowywany przez dłuższy czas, można go przechowywać w temperaturze 2–8 ℃.
Bufor PSL1 można umieścić w temperaturze 4℃ na 1 miesiąc po dodaniu β-merkaptoetanolu (zaleca się dodanie go w tym samym czasie eksperymentu).
Kolumna zatkana
Po zatkaniu kolumny wydajność RNA jest zmniejszona lub wręcz niemożliwa do oczyszczenia RNA, a uzyskana masa RNA jest niska.
Analiza wspólnej przyczyny:
1. Przerwy na próbki nie są dokładne.
Pęknięcie próbki nie powoduje całkowitego zablokowania KOLUMNY CZYSZCZĄCEJ DNA, wpływając jednocześnie na wydajność i jakość RNA.Zalecamy szybkie rozdrabnianie w wystarczającej ilości ciekłego azotu, gdy rozbijasz próbki. Spróbuj zmiażdżyć ścianę komórkową próbki, błonę komórkową i inną tkankę.W przypadku roślinnych próbek poliolowych polisacharydów zalecamy użycie Plant Total RNA ISOLATION KIT PLUS.
2. Podczas odsysania supernatantu oddzielonej próbki za pomocą kolumny DNA-Cleaning Column można wdychać ewentualny osad rozdrobnionych komórek.
Pobrane osady z fragmentacji komórek spowodują powstanie kolumny RNA-ONLY, która zostanie zablokowana podczas przeprowadzania operacji adsorpcji RNA (patrz krok 6).Zalecamy ostrożność podczas odsysania tego supernatantu, aby uniknąć zasysania resztek komórek.
3. Początkowa ilość próbki jest zbyt duża.
Nadmierne użycie próbki spowoduje niepełną fragmentację próbki lub niepełną lizę komórek przez bufor PSL1, co spowoduje zablokowanie kolumny oczyszczającej podczas oczyszczania.Zestaw do izolacji całkowitego RNA roślinnego Każda pojedyncza oczyszczona próbka operacyjna to 50 mg.W przypadku roślinnych próbek poliolowych polisacharydów zalecamy wypróbowanie Plant Total RNA ISOLATION KIT PLUS.
4. Temperatura wirówki jest zbyt niska.
Cały proces izolacji i oczyszczania RNA przeprowadza się w temperaturze pokojowej (20-25 st°C), z wyjątkiem tego, że próbka tkanki jest rozbijana przez ciekły azot. Temperatura niektórych wirówek kriogenicznych jest niższa niż 20℃, co może spowodować zablokowanie kolumny DNA-Cleaning Column i/lub RNA-Only Column.Jeśli tak się stanie, ustaw temperaturę wirówki na 20-25℃, Iupewnić się, że mieszanina do lizy i/lub supernatant z dodatkiem etanolu zostały wstępnie ogrzane do 37°C°C.
Brak ekstrakcji RNA lub wydajność RNA jest niska
Zwykle na skuteczność odzysku wpływa wiele czynników, takich jak: zawartość RNA w próbce, sposób działania, objętość elucji itp.
Analiza typowych przyczyn, jak poniżej:
1. Podczas operacji wykonano łaźnię lodową lub wirowanie w niskiej temperaturze (4°C).
Sugestia: Działać w temperaturze pokojowej (15-25°C) w całym procesie nie wykonywać kąpieli lodowej i wirowania w niskiej temperaturze.
2. RNA uległ degradacji z powodu niewłaściwej konserwacji próbki lub długotrwałej konserwacji próbki.
Zalecenie: Świeżo pobrane próbki należy szybko zamrozić w ciekłym azocie, a następnie przechowywać przez długi czas w temperaturze -80°C, unikać wielokrotnego zamrażania i rozmrażania próbek;lub natychmiast zanurz próbki w roztworze stabilizatora RNA RNAlater (próbki zwierzęce).
3. Niewystarczająca fragmentacja próbki i liza prowadzą do zablokowania kolumny oczyszczającej.
Sugestia: Podczas rozdrabniania tkanki upewnij się, że jest ona wystarczająco zmielona i szybko przenieś ją do wcześniej przygotowanego buforu Buffer PSL1 (upewnij się, że została dodana prawidłowa proporcja β-ME, patrz krok 1 procedury).
4. Eluent został dodany nieprawidłowo.
Sugestia: Upewnij się, że ddH2O wolna od RNaz została wkroplona na środek membrany kolumny oczyszczającej.
5. Do buforu Buffer PSL2 lub Buffer PRW2 nie dodano właściwej objętości etanolu absolutnego.
Sugestia: Postępuj zgodnie z instrukcjami, dodaj odpowiednią objętość etanolu absolutnego do buforów Buffer PSL2 i Buffer PRW2 i dobrze wymieszaj przed użyciem zestawu.
6. Ilość próbki tkanki jest niewłaściwa.
Sugestia: Użyj 50 mg tkanki na 500 μl buforu Buffer PSL1.Użycie zbyt dużej ilości tkanki zmniejszy ilość ekstrahowanego RNA, a także zmniejszy się czystość otrzymanego RNA.Zdecydowanie zalecamy, aby początkowa dawka próbki nie przekraczała 50 mg na operację ekstrakcji RNA.
7. Niewłaściwa objętość elucji lub niepełna elucja.
Sugestia: Objętość eluentu kolumny oczyszczającej wynosi 50-200 μl;jeśli efekt elucji nie jest zadowalający, zaleca się wydłużenie czasu w temperaturze pokojowej po dodaniu podgrzanej ddH2O wolnej od RNaz, np. 5-10 min.
8. Kolumna oczyszczająca zawiera pozostałości etanolu po przemyciu buforem BufferPRW2.
Sugestia: Jeśli pusta probówka jest wirowana przez 1 min, a po przepłukaniu buforem PRW2 nadal pozostaje etanol, można wydłużyć czas wirowania pustej probówki do 2 min lub umieścić kolumnę oczyszczającą w temperaturze pokojowej na 5 min, aby całkowicie usunąć pozostały etanol.
9.Zestaw został użyty nieprawidłowo.
Sugestia: W przypadku roślinnych próbek polisacharydów polifenolowych użycie typowych zestawów, takich jak Plant Total RNA Isolation Kit, może nie być w stanie uzyskać idealnych próbek RNA.Zalecamy użycie zestawu Plant Total RNA IsolationKit Plus, który jest specjalnie zaprojektowany do próbek roślinnych polisacharydów polifenolowych.Zestaw opracowany specjalnie do ekstrakcji RNA z polifenoli i polisacharydów z próbek roślinnych.
Wartość OD260/OD280 jest niska
Elucja RNA za pomocą ddH2O i stosowana do odczytów spektrofotometru daje niskie wartości OD260/OD280.Zalecamy stosowanie 10 mM Tris-HCl, pH 7,5 (zamiast ddH2O wolnej od RNazy do elucji RNA) w celu uzyskania względnie prawidłowych wartości OD260/OD280, patrz „Oznaczenia stężenia i oczyszczania RNA” na stronie 19.
Oczyszczony RNA ulega degradacji
Jakość oczyszczonego RNA jest związana z takimi czynnikami, jak konserwacja próbki, zanieczyszczenie RNazą i manipulacja.
Analiza najczęstszych przyczyn:
1. Próbki tkanek nie były przechowywane w odpowiednim czasie po pobraniu.
Zalecenie: Jeśli próbki tkanek nie zostaną wykorzystane w czasie po pobraniu, należy natychmiast przechowywać je w ciekłym azocie w niskiej temperaturze lub przenieść je do -80°C w celu długotrwałego przechowywania po szybkim zamrożeniu w ciekłym azocie lub natychmiast zanurzyć próbki w roztworze stabilizatora RNA RNAlater (próbki zwierzęce).Do ekstrakcji RNA spróbuj użyć świeżo pobranych próbek tkanek.
2. Wielokrotne zamrażanie i rozmrażanie próbek tkanek.
Sugestia: Podczas przechowywania próbek tkanek najlepiej jest pociąć je na małe kawałki w celu konserwacji i wyjąć część z nich podczas ich używania, aby uniknąć degradacji RNA spowodowanej wielokrotnym zamrażaniem i rozmrażaniem próbek.
3. RNaza jest wprowadzana na salę operacyjną lub nie noszone rękawiczki jednorazowe, maseczki itp.
Sugestia: Eksperymenty z ekstrakcją RNA najlepiej przeprowadzać w oddzielnych operacjach RNA, a stół laboratoryjny powinien być wyczyszczony przed eksperymentem, a podczas eksperymentu należy nosić jednorazowe rękawiczki i maski, aby w największym stopniu uniknąć degradacji RNA spowodowanej wprowadzeniem RNazy.
4. Odczynnik jest zanieczyszczony RNazą podczas użycia.
Sugestia: Zastąp nową serią zestawów do ekstrakcji całkowitego RNA roślinnego do powiązanych eksperymentów.
5. Probówki wirówkowe i końcówki pipet używane do manipulacji RNA są zanieczyszczone RNazą.
Sugestia: Upewnij się, że probówki wirówkowe, końcówki do pipet, pipety itp. używane do ekstrakcji RNA są wolne od RNaz.
Podręczniki:
Instrukcja obsługi Plant Total RNA Isolation Kit Plus