Technologia diagnostyki molekularnej wykorzystuje metody biologii molekularnej do wykrywania ekspresji i struktury materiału genetycznego ludzkiego ciała i różnych patogenów, aby osiągnąć cel przewidywania i diagnozowania chorób.
W ostatnich latach, wraz z aktualizacją i iteracją technologii diagnostyki molekularnej, kliniczne zastosowanie diagnostyki molekularnej stało się coraz bardziej rozległe i dogłębne, a rynek diagnostyki molekularnej wszedł w okres szybkiego rozwoju.
Autor podsumowuje popularne na rynku technologie diagnostyki molekularnej i dzieli się na trzy części: pierwsza część przedstawia technologię PCR, druga część przedstawia technologię amplifikacji izotermicznej kwasów nukleinowych, a druga część przedstawia technologię sekwencjonowania.
01
Część I: Technologia PCR
Technologia PCR
PCR (reakcja łańcuchowa polimerazy) to jedna z technologii amplifikacji DNA in vitro, której historia sięga ponad 30 lat.
Technologię PCR zapoczątkował w 1983 roku Kary Mullis z Cetus w USA.Mullis złożył wniosek o patent PCR w 1985 roku iw tym samym roku opublikował pierwszy artykuł naukowy PCR na temat nauki.Mullis otrzymał Nagrodę Nobla w dziedzinie chemii w 1993 roku.
Podstawowe zasady PCR
PCR może amplifikować docelowe fragmenty DNA ponad milion razy.Zasada jest taka, że w katalizie polimerazy DNA nić macierzysta DNA jest używana jako matryca, a specyficzny starter jest używany jako punkt wyjścia do wydłużania.Jest replikowany in vitro poprzez etapy takie jak denaturacja, hybrydyzacja i wydłużanie.Proces tworzenia nici potomnej komplementarnej do macierzystej nici matrycowej DNA.
Standardowy proces PCR dzieli się na trzy etapy:
1. Denaturacja: użyj wysokiej temperatury do rozdzielenia podwójnych nici DNA.Wiązania wodorowe pomiędzy podwójnymi niciami DNA ulegają zerwaniu w wysokich temperaturach (93-98°C).
2. Wygrzewanie: po rozdzieleniu dwuniciowego DNA temperaturę obniża się, aby starter mógł związać się z jednoniciowym DNA.
3. Wydłużenie: Polimeraza DNA zaczyna syntetyzować komplementarne nici wzdłuż nici DNA ze związanych starterów, gdy temperatura jest obniżona.Po zakończeniu wydłużania cykl się kończy, a liczba fragmentów DNA podwaja się.
Powtarzając te trzy kroki 25-35 razy, liczba fragmentów DNA wzrośnie wykładniczo.
Pomysłowość PCR polega na tym, że można zaprojektować różne startery dla różnych genów docelowych, tak aby fragmenty genów docelowych mogły być amplifikowane w krótkim czasie.
Jak dotąd PCR można podzielić na trzy kategorie, a mianowicie zwykły PCR, fluorescencyjny ilościowy PCR i cyfrowy PCR.
Pierwsza generacja zwykłego PCR
Użyj zwykłego instrumentu do amplifikacji PCR, aby powielić docelowy gen, a następnie użyj elektroforezy w żelu agarozowym, aby wykryć produkt, można przeprowadzić tylko analizę jakościową.
Główne wady PCR pierwszej generacji:
- Skłonny do niespecyficznej amplifikacji i wyników fałszywie dodatnich.
-Wykrywanie zajmuje dużo czasu, a operacja jest uciążliwa.
- Można przeprowadzić tylko testy jakościowe.
Ilościowy PCR fluorescencyjny drugiej generacji
Ilościowy PCR z fluorescencją (PCR w czasie rzeczywistym), znany również jako qPCR, służy do monitorowania akumulacji zamplifikowanych produktów poprzez akumulację sygnałów fluorescencyjnych poprzez dodanie sond fluorescencyjnych, które mogą wskazywać postęp układu reakcyjnego, oraz do oceny wyników za pomocą krzywej fluorescencji. Można to określić ilościowo za pomocą wartości Cq i krzywej wzorcowej.
Ponieważ technologia qPCR jest przeprowadzana w systemie zamkniętym, prawdopodobieństwo zanieczyszczenia jest zmniejszone, a sygnał fluorescencyjny można monitorować w celu detekcji ilościowej, dlatego jest ona najczęściej stosowana w praktyce klinicznej i stała się dominującą technologią w PCR.
Substancje fluorescencyjne stosowane w fluorescencyjnej ilościowej reakcji PCR w czasie rzeczywistym można podzielić na: sondy fluorescencyjne TaqMan, latarnie molekularne oraz barwniki fluorescencyjne.
1) Sonda fluorescencyjna TaqMan:
Podczas amplifikacji PCR dodawana jest specyficzna sonda fluorescencyjna, podczas dodawania pary starterów.Sonda jest oligonukleotydem, a dwa końce są odpowiednio oznakowane reporterową grupą fluorescencyjną i wygaszającą grupą fluorescencyjną.
Gdy sonda jest nienaruszona, sygnał fluorescencyjny emitowany przez grupę reporterową jest absorbowany przez grupę wygaszającą;podczas amplifikacji PCR aktywność egzonukleazy 5′-3′ enzymu Taq rozszczepia i degraduje sondę, tworząc reporterową grupę fluorescencyjną i wygaszacz Grupa fluorescencyjna jest oddzielana, dzięki czemu system monitorowania fluorescencji może odbierać sygnał fluorescencji, to znaczy za każdym razem, gdy nić DNA jest amplifikowana, tworzona jest cząsteczka fluorescencyjna, a gromadzenie się sygnału fluorescencyjnego jest całkowicie zsynchronizowane z tworzeniem produktu PCR.
2) barwniki fluorescencyjne SYBR:
W układzie reakcyjnym PCR dodaje się nadmiar barwnika fluorescencyjnego SYBR.Po niespecyficznym włączeniu barwnika fluorescencyjnego SYBR do podwójnej nici DNA, emituje on sygnał fluorescencyjny.Cząsteczka barwnika SYBR, która nie jest włączona do łańcucha, nie będzie emitować żadnego sygnału fluorescencyjnego, zapewniając w ten sposób sygnał fluorescencyjny. Wzrost produktów PCR jest całkowicie zsynchronizowany ze wzrostem produktów PCR.SYBR wiąże się tylko z dwuniciowym DNA, więc krzywą topnienia można wykorzystać do określenia, czy reakcja PCR jest specyficzna.
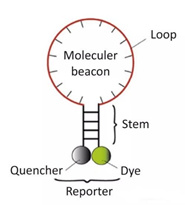
3) Latarnie molekularne
Jest to podwójnie znakowana sonda oligonukleotydowa z pętlą łodygi, która tworzy strukturę spinki do włosów z około 8 zasadami na końcach 5 i 3.Sekwencje kwasów nukleinowych na obu końcach są komplementarnie sparowane, co powoduje, że grupa fluorescencyjna i grupa wygaszająca są szczelne.Zamknij, nie spowoduje to fluorescencji.
Po wytworzeniu produktu PCR, podczas procesu wyżarzania, środkowa część latarni molekularnej jest parowana z określoną sekwencją DNA, a gen fluorescencyjny jest oddzielany od genu wygaszacza w celu wytworzenia fluorescencji.
Główne wady PCR drugiej generacji:
Wciąż brakuje czułości, a wykrywanie próbek o niskiej liczbie kopii nie jest dokładne.
Występuje wpływ wartości tła, a wynik jest podatny na zakłócenia.
Cyfrowy PCR trzeciej generacji
Cyfrowy PCR (DigitalPCR, dPCR, Dig-PCR) oblicza liczbę kopii sekwencji docelowej poprzez wykrywanie punktu końcowego i może przeprowadzać dokładne bezwzględne wykrywanie ilościowe bez stosowania kontroli wewnętrznych i krzywych wzorcowych.
Cyfrowy PCR wykorzystuje wykrywanie punktu końcowego i nie zależy od wartości Ct (progu cyklu), więc wydajność amplifikacji ma mniejszy wpływ na reakcję cyfrowego PCR, a tolerancja na inhibitory reakcji PCR jest lepsza, z dużą dokładnością i powtarzalnością.
Ze względu na charakterystykę wysokiej czułości i wysokiej dokładności nie jest łatwo zakłócany przez inhibitory reakcji PCR i może osiągnąć prawdziwą bezwzględną ocenę ilościową bez standardowych produktów, co stało się gorącym punktem badań i zastosowań.
Zgodnie z różnymi formami jednostki reakcyjnej można ją podzielić na trzy typy: układy mikroprzepływowe, wiórowe i kropelkowe.
Czas postu: lipiec-08-2021