Przeciwciała, zwane także immunoglobulinami (Ig), są glikoproteinami, które specyficznie wiążą się z antygenami.
Konwencjonalny preparat przeciwciał jest wytwarzany przez immunizację zwierząt i zbieranie surowicy odpornościowej.Dlatego surowica odpornościowa zwykle zawiera przeciwciała przeciwko innym niepowiązanym antygenom i innym składnikom białkowym w surowicy.Ogólne cząsteczki antygenu zawierają przeważnie wiele różnych epitopów, więc konwencjonalne przeciwciała są również mieszaniną przeciwciał przeciwko wielu różnym epitopom.Nawet konwencjonalne przeciwciała surowicy skierowane przeciwko temu samemu epitopowi nadal składają się z heterogenicznych przeciwciał wytwarzanych przez różne klony limfocytów B.Dlatego konwencjonalne przeciwciała surowicy są również nazywane przeciwciałami poliklonalnymi lub w skrócie przeciwciałami poliklonalnymi.
Przeciwciało monoklonalne (przeciwciało monoklonalne) jest wysoce jednorodnym przeciwciałem wytwarzanym przez pojedynczy klon komórki B i skierowanym tylko przeciwko określonemu epitopowi.Zwykle jest przygotowywany za pomocą technologii hybrydoma - technologia przeciwciał hybrydomy opiera się na technologii fuzji komórek, łącząc komórki B ze zdolnością do wydzielania specyficznych przeciwciał i komórek szpiczaka o nieskończonej zdolności wzrostu w hybrydomy komórek B.Ta komórka hybrydoma ma cechy komórki macierzystej.Może namnażać się w nieskończoność i nieśmiertelnie in vitro, jak komórki szpiczaka, a także może syntetyzować i wydzielać specyficzne przeciwciała, takie jak limfocyty śledziony.Przez klonowanie można otrzymać linię monoklonalną pochodzącą z pojedynczej komórki hybrydomy, to jest linię komórkową hybrydomy.Wytwarzane przez nią przeciwciała są wysoce jednorodnymi przeciwciałami przeciwko tej samej determinancie antygenowej, czyli przeciwciałami monoklonalnymi.
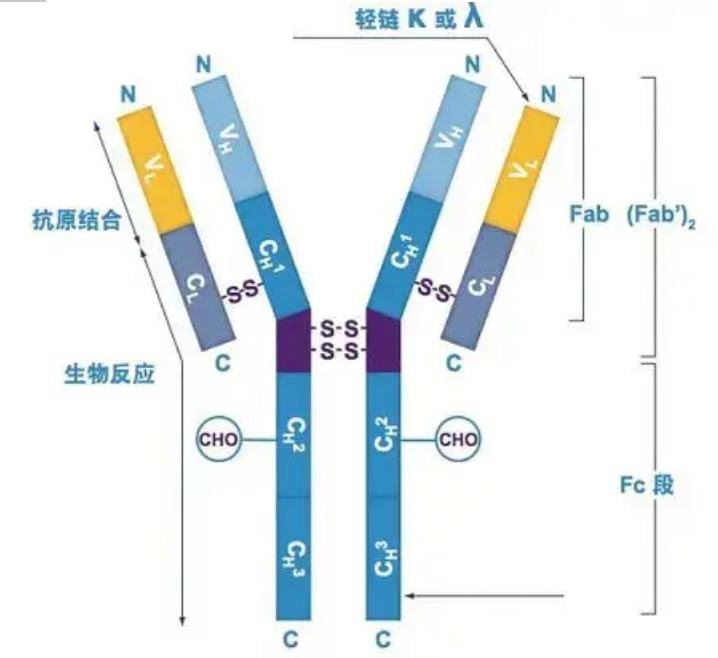
Przeciwciała istnieją jako jeden lub więcej monomerów w kształcie litery Y (tj. przeciwciała monoklonalne lub przeciwciała poliklonalne).Każdy monomer w kształcie litery Y składa się z 4 łańcuchów polipeptydowych, w tym dwóch identycznych łańcuchów ciężkich i dwóch identycznych łańcuchów lekkich.Łańcuch lekki i łańcuch ciężki są nazywane zgodnie z ich masą cząsteczkową.Wierzchołek struktury w kształcie litery Y to region zmienny, który jest miejscem wiązania antygenu.(Fragment koncepcji Detai Bio-Monoclonal Antibody Concept)
Struktura przeciwciała
 Ciężki łańcuch
Ciężki łańcuch
Istnieje pięć typów łańcuchów ciężkich Ig ssaków, nazwanych greckimi literami α, δ, ε, γ i μ.Odpowiednie przeciwciała to IgA, IgD, IgE, IgG i IgM.Różne łańcuchy ciężkie różnią się wielkością i składem.α i γ zawierają około 450 aminokwasów, podczas gdy μ i ε zawierają około 550 aminokwasów.
Każdy łańcuch ciężki ma dwa regiony: region stały i region zmienny.Wszystkie przeciwciała tego samego typu mają ten sam region stały, ale istnieją różnice między przeciwciałami różnych typów.Regiony stałe łańcuchów ciężkich γ, α i δ składają się z trzech domen Ig w tandemie, z regionem zawiasowym zwiększającym jego elastyczność;regiony stałe łańcuchów ciężkich μ i ε składają się z 4 domen Ig.Region zmienny łańcucha ciężkiego przeciwciała wytwarzanego przez różne komórki B jest inny, ale region zmienny przeciwciała wytwarzany przez tę samą komórkę B lub klon komórki jest taki sam, a region zmienny każdego łańcucha ciężkiego ma długość około 110 aminokwasów., I tworzą pojedynczą domenę Ig.
Lekki łańcuch
Istnieją tylko dwa rodzaje łańcuchów lekkich u ssaków: typu lambda i typu kappa.Każdy łańcuch lekki ma dwie połączone domeny: region stały i region zmienny.Długość łańcucha lekkiego wynosi około 211~217 aminokwasów.Dwa łańcuchy lekkie zawarte w każdym przeciwciele są zawsze takie same.W przypadku ssaków łańcuch lekki w każdym przeciwciele ma tylko jeden typ: kappa lub lambda.U niektórych niższych kręgowców, takich jak ryby chrzęstne (ryby chrzęstne) i ryby kostnoszkieletowe, występują również inne typy łańcuchów lekkich, takie jak typu jota (jota).
Segmenty Fab i Fc
Segment Fc można bezpośrednio łączyć z enzymami lub barwnikami fluorescencyjnymi w celu znakowania przeciwciał.Jest to część, w której przeciwciało nituje płytkę podczas procesu ELISA, a także część, w której drugie przeciwciało jest rozpoznawane i wiązane w immunoprecypitacji, immunoblottingu i immunohistochemii.Przeciwciała mogą być hydrolizowane do dwóch segmentów F(ab) i jednego segmentu Fc przez enzymy proteolityczne, takie jak papaina, lub mogą być odrywane od regionu zawiasowego przez pepsynę i hydrolizowane do jednego segmentu F(ab)2 i jednego segmentu Fc.Fragmenty przeciwciał IgG są czasami bardzo przydatne.Ze względu na brak segmentu Fc, segment F(ab) nie wytrąci się wraz z antygenem, ani nie zostanie wychwycony przez komórki odpornościowe w badaniach in vivo.Ze względu na małe fragmenty cząsteczkowe i brak funkcji sieciowania (ze względu na brak segmentu Fc), segment Fab jest zwykle używany do radioznakowania w badaniach funkcjonalnych, a segment Fc jest używany głównie jako środek blokujący w barwieniu histochemicznym.
Regiony zmienne i stałe
Region zmienny (region V) znajduje się w 1/5 lub 1/4 (zawiera około 118 reszt aminokwasowych) łańcucha H w pobliżu N-końca i 1/2 (zawiera około 108-111 reszt aminokwasowych) w pobliżu N-końca łańcucha L.Każdy region V ma pierścień peptydowy utworzony przez wewnątrzłańcuchowe wiązania dwusiarczkowe, a każdy pierścień peptydowy zawiera około 67 do 75 reszt aminokwasowych.Skład i układ aminokwasów w regionie V określa specyficzność wiązania antygenu przez przeciwciało.Ze względu na stale zmieniające się typy i sekwencje aminokwasów w regionie V, może powstać wiele rodzajów przeciwciał o różnych specyficznościach wiązania antygenu.Regiony V łańcucha L i łańcucha H nazywane są odpowiednio VL i VH.W VL i VH skład aminokwasowy i sekwencja niektórych lokalnych regionów mają wyższy stopień zmienności.Regiony te nazywane są regionami hiperzmiennymi (HVR).Skład aminokwasowy i rozmieszczenie części innych niż HVR w regionie V są stosunkowo konserwatywne, co nazywa się regionem zrębowym.Istnieją trzy regiony hiperzmienne w VL, zwykle zlokalizowane odpowiednio przy resztach aminokwasowych od 24 do 34 i od 89 do 97.Trzy HVR VL i VH nazywane są odpowiednio HVR1, HVR2 i HVR3.Badania i analiza rentgenowskiej dyfrakcji kryształów dowiodły, że region hiperzmienny jest rzeczywiście miejscem, w którym wiąże się antygen przeciwciała, dlatego nazywa się go regionem determinującym komplementarność (CDR).HVR1, HVR2 i HVR3 VL i VH można nazwać odpowiednio CDR1, CDR2 i CDR3.Ogólnie CDR3 ma wyższy stopień hiperzmienności.Region hiperzmienny jest również głównym miejscem występowania idiotypowych determinant cząsteczek Ig.W większości przypadków łańcuch H odgrywa ważniejszą rolę w wiązaniu z antygenem.
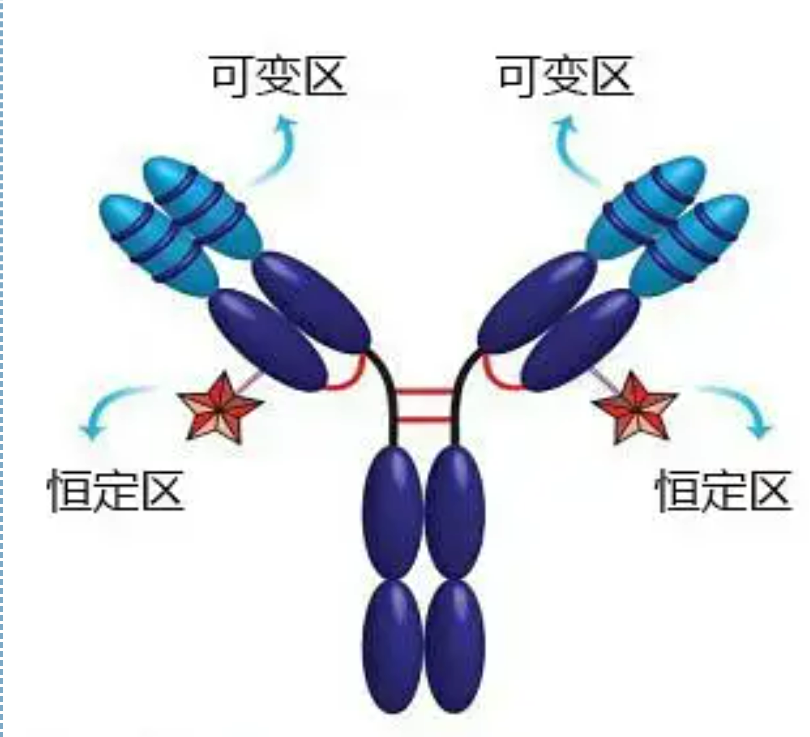 Region stały (region C)znajduje się w 3/4 lub 4/5 (w przybliżeniu od aminokwasu 119 do C-końca) łańcucha H w pobliżu C-końca i 1/2 (zawiera około 105 reszt aminokwasowych) w pobliżu C-końca łańcucha L.Każdy region funkcjonalny łańcucha H zawiera około 110 reszt aminokwasowych i zawiera pierścień peptydowy składający się z 50-60 reszt aminokwasowych połączonych wiązaniami dwusiarczkowymi.Skład aminokwasowy i układ tego regionu są względnie stałe w tym samym łańcuchu izotypu L zwierzęcej Ig iw tym samym łańcuchu typu H.To samo, może specyficznie wiązać się tylko z odpowiednim antygenem, ale struktura jego regionu C jest taka sama, to znaczy ma tę samą antygenowość.Końskie anty-ludzkie przeciwciało drugorzędowe IgG (lub anty-przeciwciało) można połączyć z dwoma. Występuje kombinacja przeciwciał (IgG) przeciwko różnym egzotoksynom.Jest to ważna podstawa do przygotowania drugorzędowych przeciwciał i zastosowania fluoresceiny, izotopów, enzymów i innych znakowanych przeciwciał.
Region stały (region C)znajduje się w 3/4 lub 4/5 (w przybliżeniu od aminokwasu 119 do C-końca) łańcucha H w pobliżu C-końca i 1/2 (zawiera około 105 reszt aminokwasowych) w pobliżu C-końca łańcucha L.Każdy region funkcjonalny łańcucha H zawiera około 110 reszt aminokwasowych i zawiera pierścień peptydowy składający się z 50-60 reszt aminokwasowych połączonych wiązaniami dwusiarczkowymi.Skład aminokwasowy i układ tego regionu są względnie stałe w tym samym łańcuchu izotypu L zwierzęcej Ig iw tym samym łańcuchu typu H.To samo, może specyficznie wiązać się tylko z odpowiednim antygenem, ale struktura jego regionu C jest taka sama, to znaczy ma tę samą antygenowość.Końskie anty-ludzkie przeciwciało drugorzędowe IgG (lub anty-przeciwciało) można połączyć z dwoma. Występuje kombinacja przeciwciał (IgG) przeciwko różnym egzotoksynom.Jest to ważna podstawa do przygotowania drugorzędowych przeciwciał i zastosowania fluoresceiny, izotopów, enzymów i innych znakowanych przeciwciał.
Produkty powiązane:
Zestaw Cell Direct RT-qPCR
Czas postu: 30 września 2021 r








